钙敏感受体参与高糖诱导的内皮细胞内质网应激的作用研究
宋振蓉1,刘晓玲1,陈 敏1,李 洁1,高雪梅2,张轩萍1
(1.山西医科大学药理学教研室,山西 太原 030001;2.山西卫生健康职业学院生理学教研室,山西 晋中 030619)
摘要:目的 研究敏感受体(CaSR)在高糖诱导的人脐静脉内皮细胞(HUVEC)中的表达及其与内质网应激的关系。方法 将HUVEC细胞分为正常糖对照组(NG组)、高糖组(HG组)、正常糖+CaSR激动剂组(NG+GdCl3 组)、高糖+CaSR拮抗剂组(HG+NPS-2390组),以不同条件孵育72 h。用CCK-8法检测细胞存活率,用试剂盒检测乳酸脱氢酶、一氧化氮、脂质过氧化物、活性氧和细胞内钙离子的水平。用Western blot法检测CaSR和细胞内质网应激标志性蛋白的表达水平。结果 HG组和NG+GdCl3 组的细胞存活率下降,LDH漏出增多,细胞内钙离子浓度升高,CaSR蛋白表达增多,氧化应激反应增强,内质网应激标志蛋白GRP78、p-PERK、p-IRE1α蛋白表达水平增高,说明高糖和CaSR激活会导致HUVEC细胞损伤,发生内质网应激。HG+NPS-2390组细胞损伤、氧化应激和内质网应激明显减轻。结论 CaSR参与了高糖导致的HUVEC细胞损伤和内质网应激,抑制CaSR,可减轻高糖导致的内皮细胞损伤。
关键词:钙敏感受体;高糖;内皮细胞损伤;氧化应激;内质网应激;HUVEC
高血糖是糖尿病的主要病理特征,会引起一系列心血管并发症,病变涉及心肌细胞和血管内皮细胞等[1]。内皮细胞位于血管壁内层,直接暴露于血管中的各种刺激,高血糖会导致血管内皮细胞内质网应激(endoplasmic reticulum stress,ERS),最终引发动脉粥样硬化等糖尿病心血管并发症[1]。而细胞内钙浓度的变化,是引发ERS的起始因素之一[2],进一步导致内皮细胞受损。钙敏感受体(calcium-sensing receptor,CaSR)是G蛋白偶联受体(G protein-coupled receptors,GPCRs)家族第Ⅱ组成员,对细胞内Ca2+浓度有重要的调节作用[3]。本研究旨在探讨高糖所致的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)损伤中,CaSR与细胞损伤和内质网应激之间的关系。
1 材料与方法
1.1 材料
1.1.1 细胞 人脐静脉内皮细胞(HUVECs)(CL-0122, 武汉普诺赛生命科技有限公司);
1.1.2 药品与试剂 GdCl3(G7532, Sigma-Aldrich);NPS-2390(11989-5, Cayman Chemical);DMEM低糖培养基(SH30021.01)、DMEM高糖培养基(SH30022.01)(HyClone);细胞活力及毒性CCK-8检测试剂盒(AR1160)、BCA蛋白浓度测定试剂盒(AR1189)(武汉博士德生物工程有限公司);活性氧检测试剂盒(S0033S)、乳酸脱氢酶细胞毒性检测试剂盒(C0016)、一氧化氮检测试剂盒(S0021)、Fluo-4 AM钙离子荧光探针(S1060)(上海碧云天生物技术有限公司);MDA测定试剂盒(A003-2-2)(南京建成生物工程研究所);抗CaSR(sc-47741)、抗PERK(sc-377400)(Santa Cruz);抗p-PERK(3179, Cell Signaling Technology),抗GRP78(ab21685)、抗IRE1α(ab37073)、抗p-IRE1α(ab48187)、抗ATF6(ab135707)、抗β-actin(ab8226)(Abcam);辣根过氧化物酶标记山羊抗兔、抗鼠二抗(北京中杉金桥生物技术有限公司);SDS-PAGE凝胶制备试剂盒、ECL超敏发光液(北京索莱宝科技有限公司)。
1.1.3 实验仪器 BB150-2TCS CO2细胞培养箱、高速冷冻离心机、超低温冰箱(Thermo Fisher Scientific);倒置生物显微镜(AE2000, 麦克奥迪实业集团有限公司);低速离心机(SC-04, 中科中佳科学仪器有限公司);灭菌器(GI54TW, 南京庚辰科学仪器有限公司);电热鼓风干燥箱(CS101-2EBN, 重庆华茂仪器有限公司);细胞超净工作台(ZHJH-C1112B, 上海智诚仪器有限公司);全自动酶标仪(SMATB, BioTek);小型垂直电泳仪、电泳电源、半干转膜仪、ChemiDoc XRS凝胶成像系统(Bio-rad)。
1.2 方法
1.2.1 细胞培养与分组 在37 ℃、5% CO2的培养箱内用含10%胎牛血清,100 kU·L-1青霉素和0.1 g·L-1链霉素的DMEM培养基培养HUVEC细胞,每2~3 d换液,待细胞贴壁达80%~90%时,可进行传代。
将细胞以无血清低糖DMEM饥饿12 h后,按以下实验分组干预72 h:①正常糖对照组(NG, 5.5 mmol·L-1 Glu);②高糖组(HG, 25 mmol·L-1 Glu);③正常糖+CaSR激动剂GdCl3组(NG+GdCl3, 5.5 mmol·L-1 Glu+300 μmol·L-1 GdCl3);④高糖+CaSR拮抗剂NPS-2390组(HG+NPS-2390, 25 mmol·L-1 Glu+10 μmol·L-1 NPS-2390)。
1.2.2 细胞损伤与毒性的检测 采用CCK-8试剂盒检测细胞活力,在96孔板中每孔加入100 μL细胞悬液(约为5×103个细胞),待细胞完全贴壁后饥饿12 h,随后按分组干预72 h,每孔加入10 μL CCK-8溶液,在培养箱内孵育2 h后,在酶标仪上测定450 nm处的吸光度值。
采用乳酸脱氢酶(lactate dehydro genase,LDH)试剂盒检测培养液上清LDH含量,到预定时间前1 h时,在设定的样品最大酶活性孔中加入20 μL LDH释放剂,吹打混匀放回培养箱继续培养。1 h后取出培养板,离心并吸取上清120 μL,按说明书进行后续操作,测定490 nm处吸光度。
采用NO试剂盒检测培养液上清中NO的含量,每孔取50 μL细胞培养液上清,并向其中迅速加入Griess Reagent Ⅰ 、Griess Reagent Ⅱ 液各50 μL,混匀,在酶标仪上测定540 nm处的吸光度。
1.2.3 细胞氧化应激的检测 采用活性氧(reactive oxygen species,ROS)检测试剂盒测定细胞内ROS的含量,干预结束后吸去培养基,用PBS清洗两遍,加入含有10 μmol·L-1 DCFH-DA活性氧探针的无血清培养液,在培养箱中继续孵育20 min。用无血清培养液轻柔地洗两次,以激发波长 488 nm,发射波长525 nm 在酶标仪上进行检测。
采用MDA测定试剂盒检测细胞脂质氧化水平,干预结束后吸去培养基,用PBS清洗两遍,加入150 μL裂解液,冰上裂解30 min后10 000×g离心15 min,取上清。一部分细胞裂解液用BCA法测定蛋白浓度,其余按照说明书进行MDA含量的检测。
1.2.4 细胞内钙离子浓度的检测 采用Fluo-4 AM钙离子荧光探针检测细胞内钙离子浓度,用含有2 μmol·L-1 Fluo-4 AM的无血清培养液在培养箱中孵育40 min,随后用无血清培养液轻柔地洗两次,再孵育20 min。以激发波长488 nm,发射波长为516 nm在酶标仪上检测。
1.2.5 Western blot检测相关蛋白的表达 收集细胞,加入裂解液后冰上裂解30 min,13 000 rpm 15 min离心取上清,BCA 法测蛋白浓度。蛋白定量后进行SDS-PAGE凝胶电泳,将蛋白转至PVDF膜后用5%的脱脂奶粉室温封闭2 h,分别加入相应抗体,抗CaSR(1 ∶ 1 000)、抗GRP78(1 ∶ 1 000)、抗PERK(1 ∶ 500)、抗p-PERK(1 ∶ 1 000)、抗IRE1α(1 ∶ 1 000)、抗p-IRE1α(1 ∶ 1 000)、抗ATF6(1 ∶ 1 000)、抗β-actin(1 ∶ 1 000),4 ℃孵育过夜,用TBST洗膜后加入相应的二抗(1 ∶ 5 000),在室温孵育1 h。利用凝胶成像系统曝光,使用 Image Lab 软件对图像进行灰度值分析。
1.2.6 统计学分析 实验数据均用SPSS 26.0软件进行统计处理,结果以 表示。采用GraphPad Prism 8作图,多组间比较采用one-way ANOVA法,组间两两比较采用t检验。
表示。采用GraphPad Prism 8作图,多组间比较采用one-way ANOVA法,组间两两比较采用t检验。
2 结果
2.1 高糖及CaSR导致HUVEC细胞的损伤情况 与NG组相比,HG组和NG+GdCl3组细胞存活率明显降低至(72.47±4.16)%和(71.94±4.68)%(P<0.01);LDH漏出率明显增高,为(28.71±5.40)%和(25.00±5.35)%(P<0.01);培养液上清NO含量减少,是(9.09±0.49)μmol·L-1和(9.44±0.72)μmol·L-1(P<0.01,P<0.05)。说明高糖和CaSR激活会造成内皮细胞损伤。与HG组相比,HG+NPS-2390组细胞存活率增高(82.17±4.65)%(P<0.01);LDH漏出率明显降低,为(17.06±1.80)%(P<0.01);培养液上清NO含量明显升高(10.97±0.50)μmol·L-1(P<0.01)(Fig 1)。在高糖状态下,CaSR阻断剂NPS-2390可以改善内皮细胞损伤,表明CaSR可能参与了高糖诱导的内皮损伤。
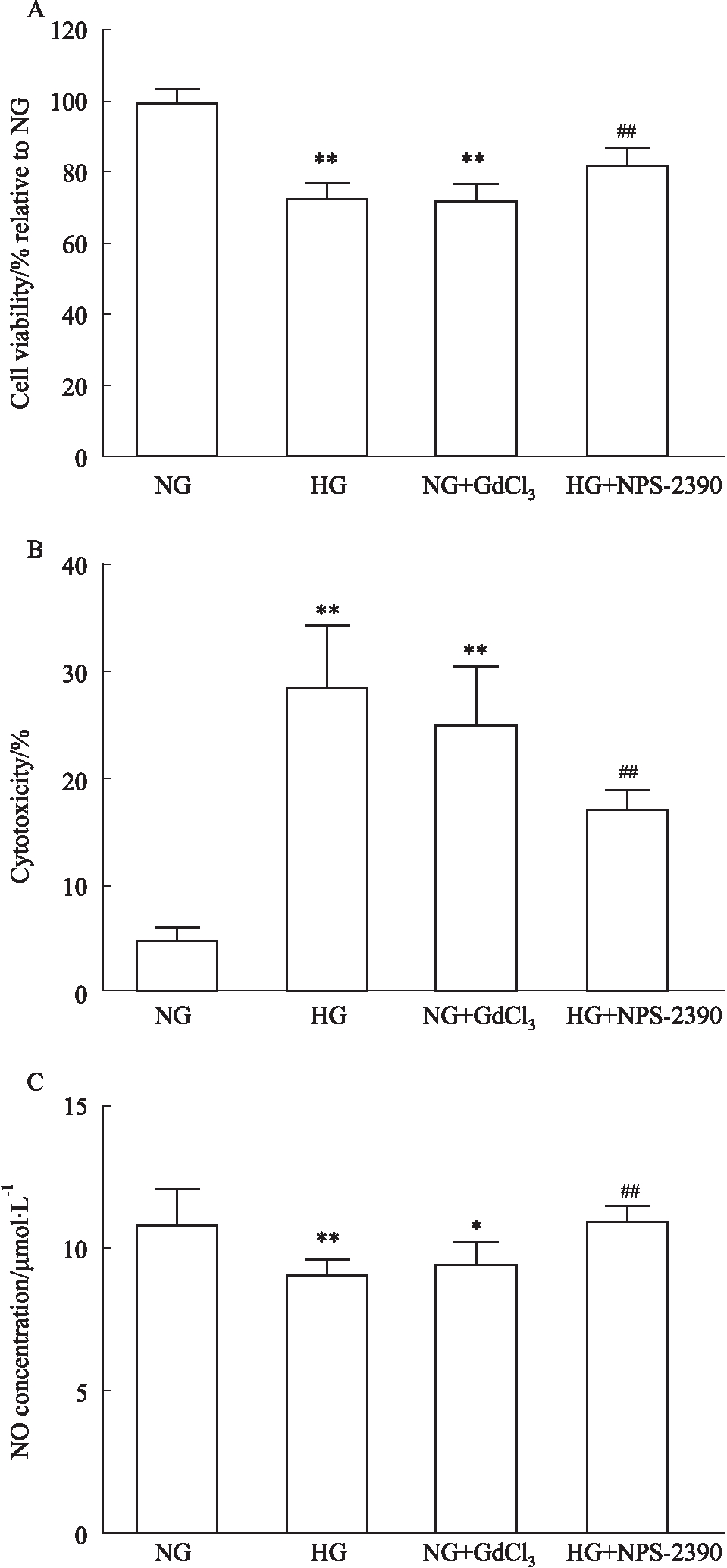
Fig 1 High glucose and CaSR activation
A. HUVEC viability; B. Concentration of LDH in HUVEC culture medium; C. Concentration of NO in HUVEC culture medium.*P<0.05, **P<0.01 vs NG, ##P<0.01 vs HG.
2.2 高糖对HUVEC细胞钙离子浓度和CaSR蛋白表达的影响 与NG组相比,HG组HUVEC细胞内钙离子浓度明显升高(313.3±30.66)(P<0.01), HG组CaSR蛋白表达增多(0.47±0.11)(P<0.01)(Fig 2)。高糖使HUVEC细胞内钙离子浓度升高,CaSR表达增多,说明钙敏感受体与高糖诱导HUVEC损伤有关。
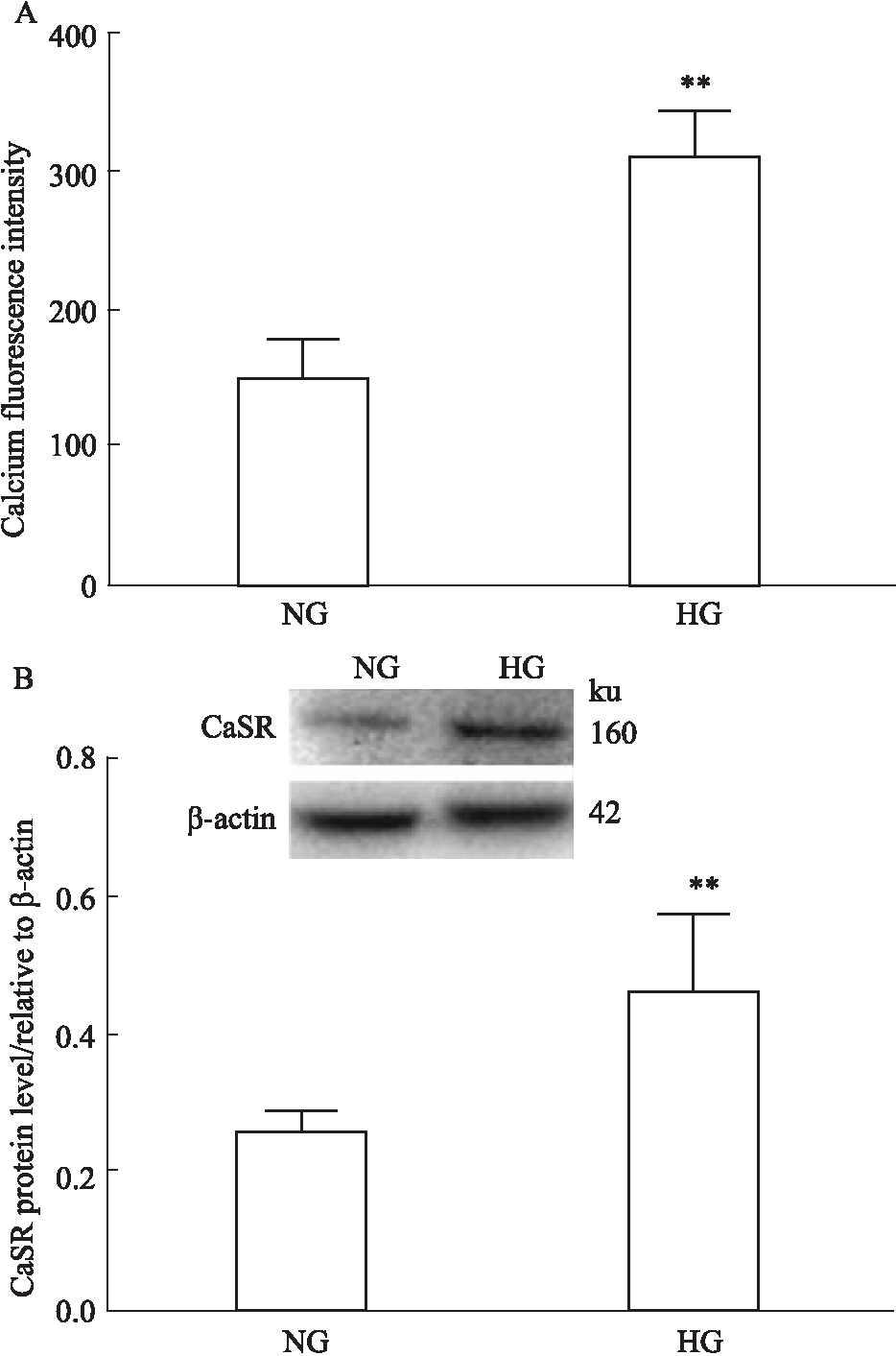
Fig 2 Effect of different sugar levels on intracellular Ca2+concentration and CaSR expression in  n=6)
n=6)
A: Intracellular Ca2+ concentration of HUVECs; B: Expression of CaSR protein.**P<0.01 vs NG.
2.3 高糖及CaSR对HUVEC细胞氧化应激的影响 与NG组相比,高糖和CaSR激动剂GdCl3使HUVEC细胞ROS水平和MDA含量明显增加(P<0.01),高糖刺激或钙敏感受体的激活,会使内皮细胞发生氧化应激。与HG组相比,钙敏感受体抑制剂NPS-2390使HUVEC细胞内ROS水平和MDA含量降低(P<0.05,P<0.01)(Fig 3),表明在高糖状态下使用CaSR抑制剂,可以减轻HUVEC的氧化应激,说明抑制钙敏感受体可以减轻高糖诱导的氧化应激。
2.4 高糖及CaSR对HUVEC细胞内质网应激的影响 与NG组相比,高糖孵育和CaSR激动剂GdCl3导致HUVEC细胞GRP78、p-PERK、p-IRE1α蛋白表达水平增高(P<0.05),发生了ERS。与HG组相比,CaSR抑制剂NPS-2390处理后,除ATF6的表达无明显改变,其他所检测的ERS标志蛋白的表达均下降(P<0.05)(Fig 4)。表明抑制CaSR可减轻高糖诱导的HUVEC内质网应激。

Fig 3 High glucose and CaSR activation induced oxidative stress in  n=6)
n=6)
A: Production of ROS; B: Concentration of MDA in HUVEC culture medium.**P<0.01 vs NG, #P<0.05, ##P<0.01 vs HG.
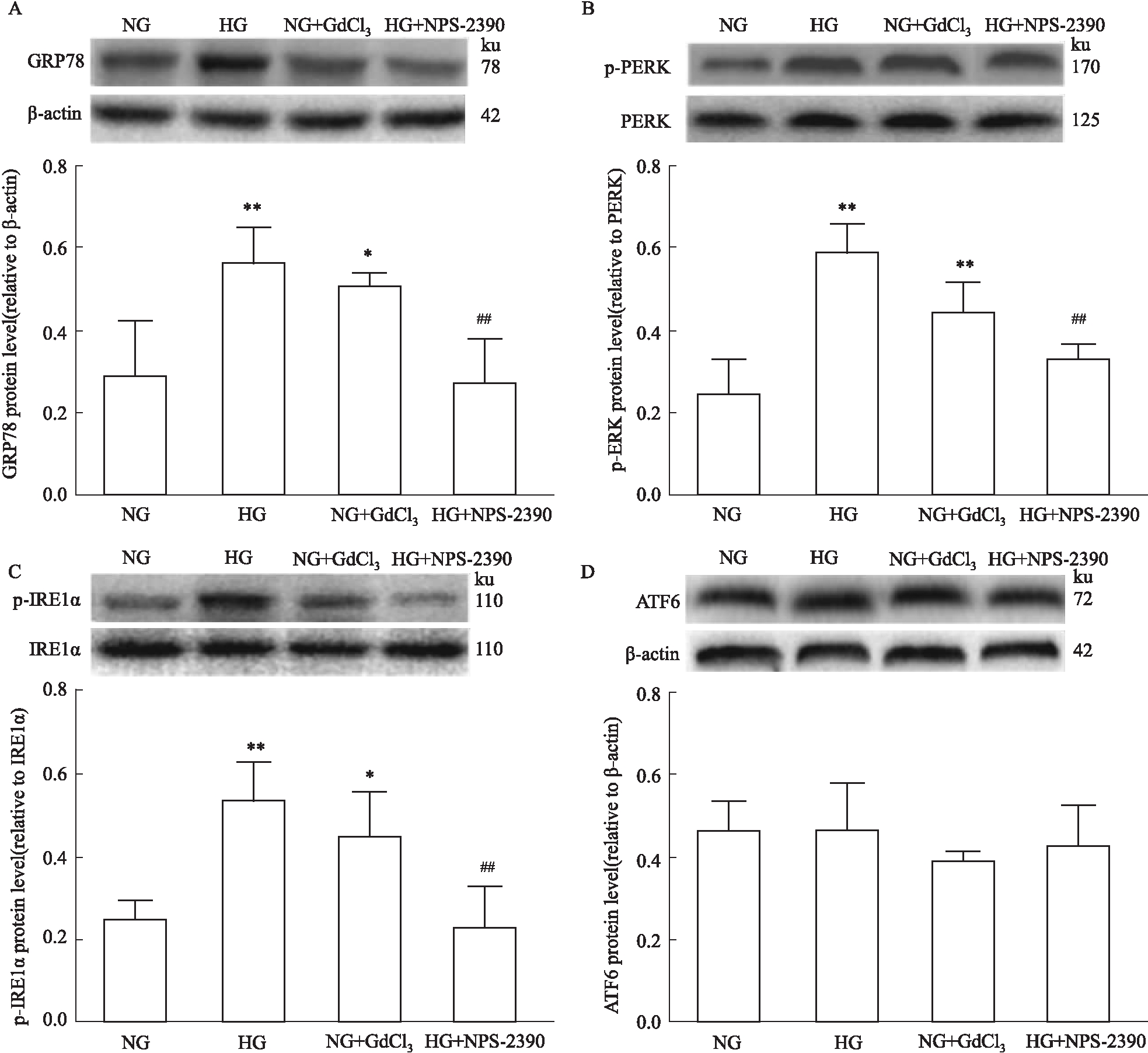
Fig 4 Expression of ERS marker protein during high glucose and CaSR  n=6)
n=6)
A: GRP78; B: p-PERK; C: p-IRE1α; D: ATF6.*P<0.05, **P<0.01 vs NG, ##P<0.01 vs HG.
3 讨论
心血管疾病是糖尿病严重的并发症之一,高血糖是动脉粥样硬化早期的重要风险因素[4]。前期在患者、动物和细胞水平的研究表明,高血糖导致的动脉粥样硬化斑块的形成,与内皮细胞功能障碍有关[5-6],其中涉及的机制包括氧化应激[7]、炎症[8]、内质网应激[9]等,本实验采用HUVEC为实验对象,因其功能与血管内皮细胞相似,故被广泛用作研究内皮细胞功能的模型[10]。我们的实验结果表明,与NG组(5 mmol·L-1)相比,HG组(25 mmol·L-1)HUVEC细胞高糖孵育72 h后细胞活力下降,LDH漏出增多,细胞NO生成减少,氧化应激反应增强,内皮细胞出现明显损伤,与先前研究结果一致[11]。同时,HG组细胞内Ca2+浓度升高,CaSR表达增多。HG组细胞GRP78、p-PERK、p-IRE1α表达增多,HUVEC发生内质网应激。说明高糖会诱导HUVEC细胞损伤、增加CaSR活性、使细胞发生内质网应激。
钙稳态对于心血管功能有重要意义,钙敏感受体属于GPCRs,首先被发现于甲状旁腺中[12],内皮细胞中同样有CaSR蛋白表达,其参与钙稳态的调节[13]。正常糖浓度下,给予细胞GdCl3(CaSR激动剂)后细胞损伤明显,说明钙敏感受体参与了细胞损伤。以25 mmol·L-1高糖刺激72 h,建立高糖诱导的HUVEC损伤模型,给予NSP-2390(CaSR抑制剂)后细胞存活率明显提高,细胞损伤明显减轻。这些结果表明,正常情况下CaSR激活会导致HUVEC细胞损伤,说明CaSR参与了细胞损伤。高糖状态下,抑制CaSR对HUVEC有保护作用。
而内质网是参与膜蛋白的合成、结合蛋白的分泌、钙稳态和脂质生物合成的一个细胞器[9],由于参与折叠反应的许多伴侣是Ca2+结合蛋白,其中一些过程,如二硫键的形成,依赖于氧化还原,因此内质网腔的特点是高Ca2+浓度和特殊的氧化还原环境[14]。当存在各种刺激时,如Ca2+稳态失衡,会导致未折叠和错误折叠的蛋白质在内质网腔内聚积,发生未折叠蛋白反应(unfolded protein response,UPR),过度的UPR会引发内质网应激[15]。研究表明,CaSR介导的信号通路会对细胞外危险信号,如ATP或Ca2+做出反应,激活磷脂酶(phospholipase C),诱导三磷酸肌醇(inositol 1,4,5-trisphosphate)与其受体作用后从内质网释放Ca2+到细胞内,而内质网出现钙剥夺,最终发生ERS[16-17]。但鲜有研究涉及高糖、CaSR和内质网应激之间是否存在联系。我们在使用CaSR激动剂与抑制剂后检测标志性蛋白以观察ERS的发生。与NG组相比,NG+GdCl3 组细胞损伤明显,GRP78、p-PERK 、p-IRE1α蛋白表达增多,另一标志性蛋白ATF6无明显改变。与HG组相比,HG+NSP-2390组细胞损伤减轻,内质网应激标志蛋白表达下降,内质网应激减轻。说明CaSR参与了高糖造成的HUVEC损伤。可能是高糖通过多种机制使胞外Ca2+内流,激活CaSR,使内质网腔钙紊乱,发生ERS,导致内皮细胞损伤。抑制CaSR能够使细胞损伤和内质网应激减轻。由此推测,CaSR和ERS在糖尿病相关内皮功能障碍中有重要作用,但其中具体的分子机制尚不明确,有待进一步研究。
综上所述,高糖会造成内皮细胞损伤,伴有细胞内钙离子浓度增高,CaSR表达增多。且高糖使HUVEC中内质网应激标志性蛋白GRP78、p-PERK、p-IRE1α表达增多,抑制CaSR可以减轻HUVEC内质网应激和细胞损伤,说明CaSR可能参与了高糖状态下内皮细胞内质网应激造成的细胞功能障碍。因此,CaSR有望成为糖尿病心血管并发症的药物研发新靶点。
参考文献:
[1] Dong Y, Fernandes C, Liu Y, et al. Role of endoplasmic reticulum stress signalling in diabetic endothelial dysfunction and atherosclerosis[J]. Diab Vasc Dis Res, 2017, 14(1): 14-23.
[2] Han G, Wang H Y, Han Z W, et al. Relationship between CaSRs and LPS-injured cardiomyocytes[J]. Int J ClinExp Pathol, 2018, 11(4): 1965-71.
[3] Brennan S C, Mun H C, Leach K, et al. Receptor expression modulates calcium-sensing receptor mediated intracellular Ca2+ mobilization[J]. Endocrinology, 2015, 156(4): 1330-42.
[4] La Sala L, Prattichizzo F, Ceriello A. The link between diabetes and atherosclerosis[J]. Eur J Prev Cardiol, 2019, 26(2_suppl): 15-24.
[5] Chistiakov D A, Revin V V, Sobenin I A, et al. Vascular endothelium: functioning in norm, changes in atherosclerosis and current dietary approaches to improve endothelial function[J]. Mini Rev Med Chem, 2015, 15(4): 338-50.
[6] Kaur R, Kaur M, Singh J. Endothelial dysfunction and platelet hyperactivity in type 2 diabetes mellitus: molecular insights and therapeutic strategies[J]. Cardiovasc Diabetol, 2018, 17(1): 121.
[7] Gou L, Zhao L, Song W, et al. Inhibition of miR-92a suppresses oxidative stress and improves endothelial function by upregulating heme oxygenase-1 in db/db Mice[J]. Antioxid Redox Signal, 2018, 28(5): 358-70.
[8] Tang S T, Wang F, Shao M, et al. MicroRNA-126 suppresses inflammation in endothelial cells under hyperglycemic condition by targeting HMGB1[J]. Vascul Pharmacol, 2017, 88: 48-55.
[9] Maamoun H, Abdelsalam S S, Zeidan A, et al. Endoplasmic reticulum stress: A critical molecular driver of endothelial dysfunction and cardiovascular disturbances associated with diabetes[J]. Int J Mol Sci, 2019, 20(7): 1658.
[10] Onat D, Brillon D, Colombo P C, et al. Human vascular endothelial cells: a model system for studying vascular inflammation in diabetes and atherosclerosis[J]. Curr Diab Rep, 2011, 11(3): 193-202.
[11] 张夏丽, 韩斯嘉, 罗 乐,等.白杨素对高糖损伤血管内皮的影响中国药理学通报, 2017, 33(5): 707-12.
[11] Zhang X L, Han S J, Luo L, et al. Effects of chrysin on impaired vascular endothelial function induced by high glucose[J]. Chin Pharmacol Bull, 2017, 33(5): 707-12.
[12] Schisano B, Harte A L, Lois K, et al. GLP-1 analogue, liraglutide protects human umbilical vein endothelial cells against high glucose induced endoplasmic reticulum stress[J]. Regul Pept, 2012, 174(1-3): 46-52.
[13] Smajilovic S, Tfelt-Hansen J. Calcium acts as a first messenger through the calcium-sensing receptor in the cardiovascular system[J]. Cardiovasc Res, 2007, 75(3): 457-67.
[14] Michalak M, Gye M C. Endoplasmic reticulum stress in periimplantation embryos[J]. Clin Exp Reprod Med, 2015, 42(1): 1-7.
[15] Zhao G L, Yu L M, Gao W L, et al. Berberine protects rat heart from ischemia/reperfusion injury via activating JAK2/STAT3 signaling and attenuating endoplasmic reticulum stress[J]. Acta Pharmacol Sin, 2016, 37(3): 354-67.
[16] Gan R, Hu G, Zhao Y, et al. Post-conditioning protecting rat cardiomyocytes from apoptosis via attenuating calcium-sensing receptor-induced endo(sarco)plasmic reticulum stress[J]. Mol Cell Biochem, 2012, 361(1-2): 123-34.
[17] Xi Y H, Li H Z, Zhang W H, et al. The functional expression of calcium-sensing receptor in the differentiated THP-1 cells[J]. Mol Cell Biochem, 2010, 342(1-2): 233-40.